Trastornos urinarios
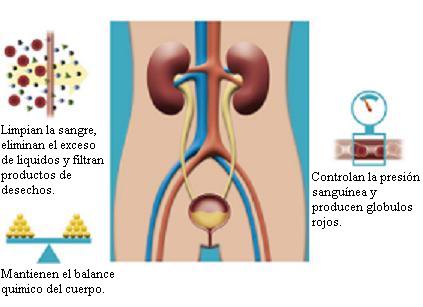
Anatomía: El Sistema Urinario, está formado por un par de riñones que son los órganos que producen la orina, un par de conductos llamados uréteres, que conducen la orina desde los riñones a la vejiga urinaria. La vejiga urinaria, es una bolsa muscular y elástica […]